1.某澄清透明溶液中可能含有:NH4+、Ba2+、Al3+、Fe2+、SO32-、SO42-、HCO3- 中的几种离子.
来源:学生作业帮 编辑:拍题作业网作业帮 分类:化学作业 时间:2024/04/17 04:17:37
1.某澄清透明溶液中可能含有:NH4+、Ba2+、Al3+、Fe2+、SO32-、SO42-、HCO3- 中的几种离子.为确定溶液组成,进行如下实验:
①测定溶液的pH,溶液显强酸性.滴加Ba(NO3)2(aq)出现白色沉淀.
②取少量溶液加入NaOH(aq)至强碱性,产生刺激性气味的气体并得到澄清溶液.
③在②的澄清溶液中通入足量CO2,有白色沉淀生成. 由此,正确的推测是
A.一定有Al3+离子 B.可能有HCO3-离子
C.不能确定SO32-离子是否存在 D.不存在Fe2+离子,可能存在Ba2+离子
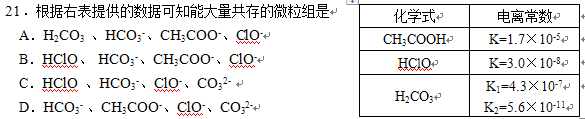
2如图所示 我知道酸性 CH3COOH >HClO>H2CO3>HCO3-然后怎么办?
①测定溶液的pH,溶液显强酸性.滴加Ba(NO3)2(aq)出现白色沉淀.
②取少量溶液加入NaOH(aq)至强碱性,产生刺激性气味的气体并得到澄清溶液.
③在②的澄清溶液中通入足量CO2,有白色沉淀生成. 由此,正确的推测是
A.一定有Al3+离子 B.可能有HCO3-离子
C.不能确定SO32-离子是否存在 D.不存在Fe2+离子,可能存在Ba2+离子
2如图所示 我知道酸性 CH3COOH >HClO>H2CO3>HCO3-然后怎么办?

第一题应该是A,强酸溶液SO32,HCO3- 不可能存在,滴加Ba(NO3)2(aq)出现白色沉淀,可排除Fe2+,因为Fe2+,会被氧化成Fe3+,溶液会变成红色,另外判断,可能有SO42;取少量溶液加入NaOH(aq)至强碱性,产生刺激性气味的气体并得到澄清溶液,刺激性气体在这些离子中只可能是NH4+产生氨气;③在②的澄清溶液中通入足量CO2,有白色沉淀生成,很可能是过量的碱,生成偏铝酸盐;而通入足量CO2后,碱被中和,生成了氢氧化铝沉淀.所以断定是A
第二题:你的酸性排序不对,应该是CH3COOH >H2CO3>HClO>HCO3-,所以答案选D
再问: 第二题是这个排序 然后怎么办
再答: 如果有CH3COOH大量存在,那后面三个酸都不可能存在,因为他们酸性相对弱,都会跟CH3COOH反应;如果H2CO3大量存在,那么HClO,HCO3-也不会大量存在;以此类推HClO大量存在,就不可能有HCO3-大量存在,因为酸性HClO>HCO3-,两者会反应;所以只有D情况,才是大量稳定存在的!
第二题:你的酸性排序不对,应该是CH3COOH >H2CO3>HClO>HCO3-,所以答案选D
再问: 第二题是这个排序 然后怎么办
再答: 如果有CH3COOH大量存在,那后面三个酸都不可能存在,因为他们酸性相对弱,都会跟CH3COOH反应;如果H2CO3大量存在,那么HClO,HCO3-也不会大量存在;以此类推HClO大量存在,就不可能有HCO3-大量存在,因为酸性HClO>HCO3-,两者会反应;所以只有D情况,才是大量稳定存在的!
1.某澄清透明溶液中可能含有:NH4+、Ba2+、Al3+、Fe2+、SO32-、SO42-、HCO3- 中的几种离子.
有一瓶澄清透明溶液,可能含有NH4+、Fe2+、Fe3+、Ba2+、Al3+、SO42-、 HCO3-、NO3-、Cl-
有一瓶澄清透明溶液,可能含有NH4+、Fe2+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、NO3-、Cl-中
某无色透明溶液只可能含有Ba2+、NH4+、K+、Al3+、Fe 3+、Cl-、SO42-离子中的几种
某澄清透明浅黄色溶液中,可能含有下列离子:K+,NH4+,Fe3+,Ba2+,Al3+,SO4 2+,HCO3 2+,C
某含有Na+的澄清溶液中,可能还含有NH4+、Fe2+、I-、Br-、CO32-、SO32-六种离子中的几种.将该溶液进
一种澄清透明的溶液中,可能含有下列离子:K+、Fe3+、Ba2+、Al3+、NH4
有一瓶澄清的溶液 其中可能含有NH4+,Na+,Al3+,Ba2+,Fe2+,SO42-,CO32-,NO3-中的一种或
某无色透明溶液中可能含有下列离子中的一种或几种:Na+、Mg2+、Al3+,Fe2+,Ba2+,I-,Cl-、SO4 2
某无色溶液中只可能含有NH4+、K+、Al3+、Fe3+、Cl-、SO42-等离子中的几种离子
某溶液中可能含有NH4+、Ba2+、Fe2+、Ag+、OH-、SO42-、CO32-中的一种或几种,现用该溶液做以下实验
某强酸性溶液X中含有Ba2+、Al3+、SiO32-、NH4+、Fe2+、Fe3+、CO32-、SO42-、NO3-中的